CONCENTRACIÓN MOLAR
La molaridad de una disolución, se refiere al número de moles de soluto que hay en 1 L de disolución. Se representa como M.
En el laboratorio, se pesan gramos de soluto, para obtener los moles, es indispensable conocer la masa molecular del compuesto que identificamos como soluto.
Ejemplo: ¿Qué concentración molar tendrán 800 mL de una disolución de NaCl, preparada con 20 g de esta sal?
DATOS:
Disolución: 800 mL
Souto: 20 g
CONVERSIONES:
Para calcular la concentración molar, necesitamos unidades de L y mol
Considerando que 1L equivale a 1000 mL: 800mL= 0.8 L
La masa molar de NaCl es 58.44 g/mol
Ya que tenemos unidades de mol y L, obtenemos fácilmente la molaridad (M)
RESULTADO:
Tenemos una concentración 0.43 M.
Ejemplo 2: ¿Cuántos gramos de NaOH se necesitan para preparar una solución 0.1 M? En el laboratorio sólo hay un matraz aforado de 50 mL.
SOLUCIÓN:
El problema nos da la concentración molar y el volumen de la disolución, lo que se debe hacer es sustituir estos valores en la "fórmula de M" y despejar los moles de soluto. Después, con la masa molecular de NaOH, se obtienen los gramos de soluto.
DATOS:
M= 0.1
0.05 L disolución
SUSTITUCIÓN Y OPERACIONES:
RESULTADO: Se necesitan pesar 0.2 g de NaOH
IMPORTANTE: SIEMPRE RECORDAR LAS UNIDADES AL REPORTAR EL RESULTADO, DE LO CONTRARIO, EL RESULTADO SE CONSIDERARÁ COMO INCORRECTO.
SERIE PARTE 3
6. ¿ Qué volumen de solución se necesita para obtener una concentración 2 molar de NaOH con 160 g de este compuesto?
7. Se desea preparar una solución 0.02 M de KMnO4 en un matraz de 100 mL ¿cuántos gramos del compuesto se deben pesar?




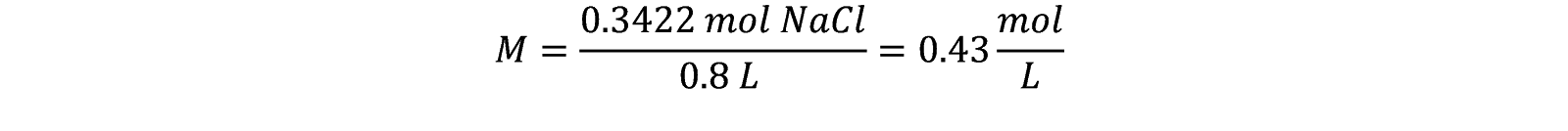

No hay comentarios:
Publicar un comentario