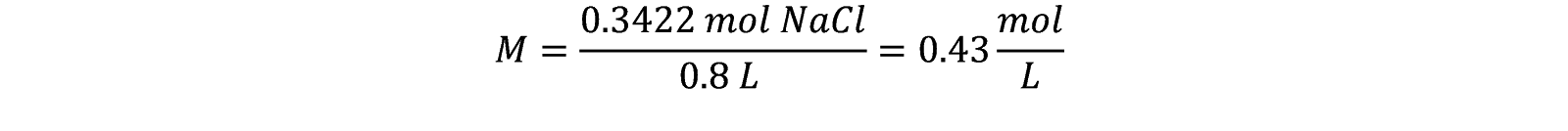Estimados alumnos, por medio de este medio, les recuerdo que tienen programado su examen para el próximo 3 de diciembre.
Recuerden que la serie es derecho a examen.
miércoles, 19 de noviembre de 2014
Concentración molar
CONCENTRACIÓN MOLAR
La molaridad de una disolución, se refiere al número de moles de soluto que hay en 1 L de disolución. Se representa como M.
En el laboratorio, se pesan gramos de soluto, para obtener los moles, es indispensable conocer la masa molecular del compuesto que identificamos como soluto.
Ejemplo: ¿Qué concentración molar tendrán 800 mL de una disolución de NaCl, preparada con 20 g de esta sal?
DATOS:
Disolución: 800 mL
Souto: 20 g
CONVERSIONES:
Para calcular la concentración molar, necesitamos unidades de L y mol
Considerando que 1L equivale a 1000 mL: 800mL= 0.8 L
La masa molar de NaCl es 58.44 g/mol
Ya que tenemos unidades de mol y L, obtenemos fácilmente la molaridad (M)
RESULTADO:
Tenemos una concentración 0.43 M.
Ejemplo 2: ¿Cuántos gramos de NaOH se necesitan para preparar una solución 0.1 M? En el laboratorio sólo hay un matraz aforado de 50 mL.
SOLUCIÓN:
El problema nos da la concentración molar y el volumen de la disolución, lo que se debe hacer es sustituir estos valores en la "fórmula de M" y despejar los moles de soluto. Después, con la masa molecular de NaOH, se obtienen los gramos de soluto.
DATOS:
M= 0.1
0.05 L disolución
SUSTITUCIÓN Y OPERACIONES:
RESULTADO: Se necesitan pesar 0.2 g de NaOH
IMPORTANTE: SIEMPRE RECORDAR LAS UNIDADES AL REPORTAR EL RESULTADO, DE LO CONTRARIO, EL RESULTADO SE CONSIDERARÁ COMO INCORRECTO.
SERIE PARTE 3
6. ¿ Qué volumen de solución se necesita para obtener una concentración 2 molar de NaOH con 160 g de este compuesto?
7. Se desea preparar una solución 0.02 M de KMnO4 en un matraz de 100 mL ¿cuántos gramos del compuesto se deben pesar?
Concentración porcentual de disoluciones
Concentración de soluciones
La concentración puede darse en diferentes formas, las principales son:
a) Porcentaje masa/masa: Las unidades son gramos
b) Porcentaje masa/volumen: Las unidades son gramos/ mililitros
c) Porcentaje volumen/ volumen: Las unidades son mililitros/ mililitros
d) Concentración molar
Los primeros tres casos, como su nombre lo indica, nos van a decir cuántas partes del soluto (componenete en menor proporción) hay en 100 partes de solución (soluto + disolvente).
1. ¿Cuál es la concentración porcentual de una disolución de NaCl si se preparó disolviendo 10 gramos de ésta en 90 gramos de agua?
Nos dan unidades de masa, por lo que usamos la ecuación %m/m. Al sustituir los valores, se debe tener cuidado de anotar en el denominador el valor de la disolución, no sólo del disolvente. La suma del soluto + el disolvente, nos dan la masa de la disolución.
DATOS:
NaCl= 10 g
H2O= 90g
SUSTITUCIÓN Y OPERACIONES
RESULTADO: 10% de NaCl2. En 200 cm3 de una disolución al 2% ¿Qué cantidad de sal se encuentra en solución?
Los cm3 son unidades de volumen, la sal de mesa (NaCl) es un sólido por lo que la cantidad que nos piden, tendrá unidades de masa. La ecuación que usaremos será la de %m/v. En este problema, la incógnita es la masa del soluto.
DATOS:
%m/v= 2
volumen de disolución= 200 mL
(1cm3 =1mL)
SUSTITUCIÓN Y OPERACIONES:
RESULTADO: Se encuentran 4 g de NaCl en solución.
NOTA MUY IMPORTANTE: LEER BIEN EL PROBLEMA, PARA IDENTIFICAR SI TENEMOS INFORMACIÓN DEL DISOLVENTE O DE LA DISOLUCIÓN. ESTO DEBE QUEDAR CLARO, YA QUE EN EL EXAMEN NO SE CONTESTARÁN DUDAS SOBRE A QUÉ SE REFIERE EL PROBLEMA.
SERIE PARTE 2.
3. Se desea preparar una solución acuosa de ácido sulfúrico al 10% en volumen. ¿qué cantidad de esta solución se obtendrá si únicamente se cuenta con 15 mL del ácido?
4. ¿Cuántos mL de alcohol se tendrán en 938 mL de Brandy al 36%?
5. ¿Qué contiene una solución al 5% m/m de NaCl? Indicar los gramos de soluto y los de disolvente.
Cálculo de masa molecular
CÁLCULO DE LA MASA MOLAR
Recordando lo que vimos en clase:
|1. Lo primero que tenemos que hacer es identificar de qué átomos está compuesta la molécula de la que queremos conocer la masa molar y lo anotamos en una lista.
2. Posteriormente, analizamos cuántos átomos de cada elemento hay en el compuesto
3. Tomamos el valor de peso atómico de la tabla periódica. ES MUY IMPORTANTE NO CONFUNDIR CON NÚMERO ATÓMICO.
4. Multiplicamos el peso atómico por el número de átomos de cada elemento que se tenga
5. Se obtiene la masa molar del compuesto sumando los resultados del paso 4
NOTA IMPORTANTE: Las unidades de la masa molar son gramos/mol (g/mol)
EJEMPLO: Obtener la masa molecular del fosfato de amonio.
SOLUCIÓN:
La fórmula del fosfato de amonio es: (NH4)3PO4 (Consultar sus tablas de aniones y cationes)
Paso 1: Tenemos átomos de:
N
H
P
O
Paso 2: Siempre que tengamos un paréntesis, el número que aparece como sub índice del paréntesis, en este caso 3, multiplicará a los subíndices de los elementos que estén dentro del paréntesis. En este caso para N, se multiplica 3 x 1 y para H se multiplica 4 x 3.
Cuando el símbolo de un elemento no tiene subíndice, significa que sólo tenemos 1 átomo de ese elemento.
Nos queda así
|
|
# de átomos
|
|
N
|
3 x 1 = 3
|
|
H
|
4 x 3= 12
|
|
P
|
1
|
|
O
|
4
|
Paso 3: Buscamos el valor de PESO ATÓMICO de nuestra tabla periódica y lo anotamos para cada elemento presente.
|
|
# de átomos
|
Peso Atómico
|
|
N
|
3
|
14.01
|
|
H
|
12
|
1.01
|
|
P
|
1
|
30.97
|
|
O
|
4
|
16
|
PASO 4: se multiplica el número de átomos por el valor de peso atómico
|
|
# de átomos
|
Peso Atómico
|
# de átomos x peso atómico
|
|
N
|
3
|
14.01
|
42.03
|
|
H
|
12
|
1.01
|
12.12
|
|
P
|
1
|
30.97
|
30.97
|
|
O
|
4
|
16
|
64
|
PASO 5. Se obtiene la masa molar sumando los resultados del paso 4
|
|
# de átomos
|
Peso Atómico
|
# de átomos x peso atómico
|
|
N
|
3
|
14.01
|
42.03
|
|
H
|
12
|
1.01
|
12.12
|
|
P
|
1
|
30.97
|
30.97
|
|
O
|
4
|
16
|
64
|
|
|
|
suma
|
149.12
g/mol
|
¡ASÍ DE FÁCIL!
EJERCICIOS DE SERIE:
1. Calcular la masa molecular de:
a) (NH4)2SO4
b) KClO4
Suscribirse a:
Comentarios (Atom)